- Регистрация
- 12 Июн 2019
- Сообщения
- 2.098
- Репутация
- 735
- Реакции
- 1.479

Нейропротекторные эффекты канна6иса в основном применяются в медицине при нейродегенеративных заболеваниях. Нейродегенеративные заболевания возникают в результате прогрессирующей утраты функции нейронов. Вторым наиболее распространенным нейродегенеративным заболеванием с началом во взрослом возрасте является болезнь Паркинсона, причем одним из наиболее распространенных является болезнь Альцгеймера. Хотя нейродегенеративные расстройства менее распространены у детей, они существуют, чаще всего в виде энцефалопатии.
Для многих нейродегенеративных заболеваний воспаление и иммунный ответ в целом являются одними из основных факторов, вызывающих повреждение и дисфункцию нейронов. По этой же причине многие нейродегенеративные расстройства возникают во взрослом возрасте.
В настоящее время не существует методов лечения нейродегенеративных заболеваний. В лучшем случае лекарства могут маскировать симптомы и, возможно, остановить дальнейшее прогрессирование болезни. Именно здесь нейропротекторные эффекты канна6иса могут сыграть свою роль в неврологии.
Эндоканна6иноидная система и нейродегенеративные состояния
Научные исследования эндоканна6иноидной системы все больше и больше раскрывают ее роль в нейропротекции и нейродегенеративных заболеваниях. Эндоканна6иноидная система представляет собой чрезвычайно сложную физиологическую сигнальную систему, в основном сосредоточенную в головном мозге. Что делает этот конкретный человеческий механизм таким интересным, так это то, что это сигнальная система, работающая в обратном направлении.
Эндогенные канна6иноиды не хранятся в пресинаптических нейронах так же, как нейротрансмиттеры. Они вырабатываются по требованию, когда «включается» триггер внутриклеточного синтеза, основным триггером являются ионы кальция. Это одна из гипотез, лежащих в основе того, почему эндоканна6иноидная система ведет себя как система «восстановления» или «исцеляющий» механизм организма.
Соответствующим примером этого является уровень эндоканна6иноидов после травмы головного мозга. Обзор 2006 года продемонстрировал чрезвычайно повышенный уровень эндогенных канна6иноидов после судорог, вызванных каиновой кислотой, токсичности глутамата, шокового стресса и травмы. Реакция эндоканна6иноидной системы на эти события предполагает, что одним из основных компенсаторных механизмов мозга после повреждения головного мозга является передача сигналов эндоканна6иноидами.
Эти результаты показывают возможную связь между эндоканна6иноидной системой и восстановлением после нейродегенерации. Таким образом, канна6ис представляет собой потенциальную мишень для медицины.
Антиоксидантные и противовоспалительные свойства канна6иса
В последние годы доказательства антиоксидантных и противовоспалительных свойств различных канна6иноидов стали общепризнанными, и наше понимание роли, которую они играют в модулировании нейротрансмиссии, расширилось.
Таким образом, в настоящее время серьезное внимание уделяется их потенциалу в качестве нейропротекторных агентов. Было показано, что канна6иноиды предотвращают гибель нейронов при остром повреждении нейронов, включая ишемический инсульт и черепно-мозговую травму, а также обеспечивают симптоматическое облегчение при рассеянном склерозе, болезни Гентингтона и других хронических нейродегенеративных заболеваниях.
Антиоксидантные эффекты - это предполагаемый механизм действия, с помощью которого канна6ис может облегчить симптомы, связанные с нейродегенеративными состояниями. Еще в 1998 году исследователи продемонстрировали антиоксидантное действие kБД , отметив, что он является более мощным антиоксидантом, чем аскорбат или токоферол. Дополнительным преимуществом является то, что kБД не обладает токсичностью, связанной с токоферолом.
Это уместно, потому что мозг является одним из наиболее уязвимых органов для окислительного стресса. Окислительный стресс — это, по сути, дисбаланс окислительно-восстановительных состояний, вызывающий чрезмерное количество активных форм кислорода. Было высказано предположение, что окислительный стресс является решающим фактором в возникновении болезни Альцгеймера. То же самое было предложено для болезни Паркинсона.
Противовоспалительные свойства канна6иса также можно считать нейропротекторным свойством растения. Считается, что опосредованная рецептором CB2 активность, которая влияет на клетки микроглии, снижает нейровоспалительные механизмы. В современном контексте лечения нейродегенеративных состояний иногда используются противовоспалительные препараты, особенно при лечении болезни Альцгеймера. Однако до сих пор были получены очень неоднозначные результаты исследований эффективности противовоспалительных средств, используемых для этой цели.
Ингибирование соединений, вызывающих повреждение
Исследование, опубликованное в 2002 г. Mechoulam et al. продемонстрировали, что продукция анандамида и 2-AG увеличивается в головном мозге после черепно-мозговой травмы. В случае черепно-мозговой травмы (ЧМТ или внутричерепной травмы) вырабатываются определенные вещества, которые, как известно, вызывают повреждение нейронов: фактор некроза опухоли-а и активные формы кислорода (АФК). Исследование показало, что производство анандамида и 2-AG ингибирует производство этих потенциально вредных веществ. Анандамид и 2-AG являются эндогенными канна6иноидами, которые вырабатываются собственной эндоканна6иноидной системой организма.
В другом исследовании Mechoulam изучался ингибирующий потенциал 2-AG и анандамида in vivo. Исследование проводилось на мышах и крысах с ЧМТ. Когда оба соединения вводили мышам и крысам с травмами головного мозга, степень повреждения головного мозга уменьшалась. Было отмечено уменьшение степени отека головного мозга (накопление жидкости, приводящее к отеку), объема инфаркта (степень некроза ткани) и гибели клеток гиппокампа, наряду с общим улучшением клинического выздоровления.
Причина, по которой это относится к лекарственному канна6ису, заключается в том, что теперь известно, что kБД повышает уровень анандамида в сыворотке крови. Анандамид расщепляется гидролазой амидов жирных кислот (FAAH), интегральным мембранным ферментом. Анандамид доставляется к ферменту FAAH с помощью белка, связывающего жирные кислоты (FABP). FABP — это белки, ответственные за транспортировку других молекул. kБД ингибирует FABP, что, в свою очередь, нарушает доставку анандамида в FAAH, тем самым повышая уровень анандамида в сыворотке. Интересно, что исследователи также продемонстрировали, что неканна6иноидные соединения канна6иса также слабо ингибируют MAGL, фермент, ответственный за расщепление 2-AG.
Канна6иноиды в восстановлении после инсульта
ТГk, kБД и различные другие канна6иноиды неоднократно изучались для оценки их нейропротекторного действия во время и после возникновения ишемического инсульта (ИИ). Несмотря на то, что существуют различные исследования, показывающие, что употребление канна6иса может увеличить риск инсульта, похоже, что это явление ограничено небольшой подгруппой восприимчивых людей. В 27% этих случаев обратимая церебральная вазоконстрикция, вызванная употреблением канна6иноидов, может быть убедительным механизмом инсульта. Для большинства канна6иноидная терапия обладает большим потенциалом для смягчения воспаления и окислительного стресса, вызванного ИИ.
kБД был предметом многочисленных исследований в качестве нейропротектора при ИИ. Было показано, что он увеличивает мозговой кровоток после ИИ и тем самым способствует уменьшению объема инфаркта. 14-дневное повторное лечение kБД (10 мг/кг) приводило к толерантности к гипотермии и к толерантности к нейропротекторным эффектам. По этой причине считается, что в этой области исследований он обладает большим терапевтическим потенциалом, чем ТГk. Также было показано, что kБД уменьшает воспаление, вызванное высвобождением интерлейкина-1, оксида азота и фактора некроза опухоли-а после ИИ.
Как и при ЧМТ, большая часть повреждений после ИИ связана с окислительным стрессом, вызванным накоплением АФК из-за чрезмерной глутаматергической передачи сигналов. Было показано, что и ТГk, и kБД являются эффективными антиоксидантами (как было продемонстрировано ранее), которые ингибируют глутаматергическую передачу сигналов и тем самым уменьшают степень накопления АФК после ишемического инсульта. Тем не менее, kБД снова демонстрирует большую эффективность в качестве антиоксиданта и, следовательно, имеет больший терапевтический потенциал, чем ТГk, при дегенеративных состояниях.
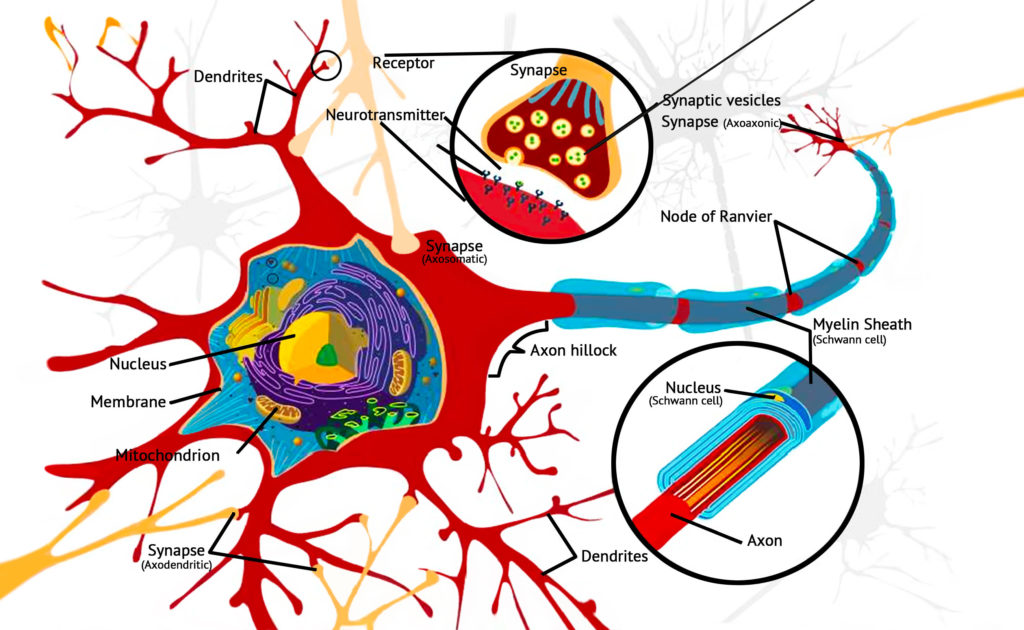
Сигнальная система глутамата и канна6иноиды
Глутамат является самым распространенным нейротрансмиттером в человеческом мозгу. Это возбуждающий нейротрансмиттер, который играет роль в нейронных цепях, связанных с синаптической пластичностью. Усиливая или ослабляя передачу сигналов между нейронами, глутамат играет жизненно важную роль в обучении и памяти. Возможно, это самый важный нейротрансмиттер в мозге, определяющий то, как человек сохраняет информацию, и играет важную роль в долгосрочной потенциации.
Высокие уровни глутамата вызывают нейротоксичность (в частности, опосредованную рецепторами NMDA, AMPA и каинат-глутамата) и приводят к образованию соединений, вызывающих вторичное повреждение, таких как АФК и фактор некроза опухоли-а. Также известно, что активность глутамата снижается в присутствии антиоксидантов. Поскольку kБД и ТГk были продемонстрированы как антиоксиданты, есть четкая основа для дальнейшего изучения канна6иноидов в этой конкретной области неврологии.
Взаимодействия между различными канна6иноидами и глутаматергической сигнальной системой были исследованы в исследовании под названием « Нейропротекторные антиоксиданты из мари}{уаны», опубликованном в 2000 году: kБД продемонстрировал самые высокие антиоксидантные свойства для предотвращения токсичности глутамата.
Канна6иноидный рецептор-независимый механизм
Авторы книги «Нейропротекторные антиоксиданты из мари}{уаны» также продемонстрировали, что как ТГk, так и kБД усиливают нейропротекцию и снижают нейротоксичность NMDA, AMPA и каинатных рецепторов. Кроме того, уровень нейропротекции не повышался под действием специфических антагонистов канна6иноидных рецепторов, что указывает на то, что механизм действия не зависит от канна6иноидных рецепторов.
Предыдущие исследования пришли к выводу, что рецепторы CB2 играют роль в этих ключевых клеточных процессах. Это формирует основу для идеи, что селективные агонисты этого типа рецепторов могут действовать на «двух сторонах медали», обеспечивая цитопротекцию здоровых нервных клеток или вызывая апоптоз опухолевых клеток. Однако kБД обычно не ведет себя как агонист, поэтому его нейропротекторный потенциал должен быть реализован в другом месте.
Также было показано, что kБД снижает токсичность гидропероксида (разновидность АФК) в культурах нейронных клеток, что еще раз доказывает его эффективность в качестве антиоксиданта. Хотя эти тесты проводились in vitro, предварительные исследования церебральной ишемии у крыс in vivo показывают, что он эффективен во всех отношениях.
Перинатальное гипоксически-ишемическое событие
Значимой причиной поражения головного мозга в неонатальном периоде является перинатальное гипоксически-ишемическое событие. Это когда приток кислорода и крови к мозгу младенца прерывается из-за асфиксии, часто во время родов. Это губительное состояние приводит к гибели 15-20% детей с диагнозом.
Это состояние также может привести к серьезным неврологическим нарушениям, таким как эпилепсия, церебральный паралич, двигательная дисфункция и гиперактивность еще в 25%. Развивающийся мозг гораздо более восприимчив к гипоксически-ишемическим событиям, чем мозг взрослого человека. Поскольку он содержит высокую концентрацию кровеносных сосудов и более высокое содержание воды, потенциал для вызывающих повреждение событий, таких как кровотечение, выше.
Сразу же после гипоксически-ишемического повреждения головного мозга запускается набор специфических клеточных механизмов, включая повышенную выработку глутамата, вызывая повреждение клеток и, наконец, приводя к эксайтотоксичности (тип гибели клеток, вызванный чрезмерной передачей глутаматергических сигналов).
Точная природа этого процесса еще полностью не изучена из-за сложности молекулярных механизмов, лежащих в основе этого состояния. Таким образом, существует нехватка эффективных вариантов лечения для уменьшения степени повреждения нейронов. Однако теперь быстрый прогресс в нашем понимании этой области привел к тому, что новый класс нейропротекторных методов лечения должен быть оценен и внедрен, если будет доказана его эффективность.
Среди них исследуется эндоканна6иноидная система, чтобы установить ее особую роль в обеспечении нейропротекции развивающегося мозга. Хотя использование канна6иноидов у детей остается спорным, были достигнуты достаточные успехи в использовании канна6иноидов при различных педиатрических заболеваниях (включая эпилепсию и рак) без вредных побочных эффектов. В результате полемика в настоящее время быстро сменяется консенсусом среди научного сообщества в отношении того, что такие методы лечения могут иметь применение.
Канна6иноиды были предложены в качестве хороших кандидатов для лечения перинатальных травм головного мозга. Было показано, что помимо модуляции нервных реакций канна6иноиды модулируют вазодилатацию за счет функции эндотелиальных клеток и активности эндотелина, регулируют гомеостаз кальция и обладают значительным антиэксайтотоксическим и противовоспалительным действием.
Есть также указание на то, что канна6иноиды могут оказывать благотворное влияние на белое вещество. Это мозговая ткань, состоящая из нервных волокон. В этом исследовании введение селективного агониста CB1R ACEA в ранний постнатальный период (от P1 до P14) увеличивает образование предшественников олигодендроцитов. WIN, другой синтетический канна6иноид, в том же исследовании способствовал миелинизации подкоркового белого вещества.
Исследования также указывают на потенциал эндоканна6иноидов как на эндогенную восстанавливающую реакцию нейронов. Агонисты рецепторов CB, такие как ТГk, могут стимулировать этот эндогенный ответ.
Нейропротекторные свойства ТГk для стареющего населения
Исследование, опубликованное в журнале Nature Medicine в 2017 году, привлекло большое внимание средств массовой информации своим несколько необычным заявлением о том, что ТГk может оказывать омолаживающее действие на стареющий мозг. Даже Forbes и The Guardian опубликовали статьи об этом исследовании.
Для проведения клинического исследования под названием « Постоянно низкая доза Δ 9 -тетрагидроканна6инола (ТГk) восстанавливает когнитивную функцию у старых мышей» исследователи вводили низкие дозы ТГk мышам разного возраста: 2, 12 и 18 месяцев. Другими словами, молодые, зрелые и старые мыши. Это проводилось регулярно в течение четырех недель. Размер дозы имеет большое значение, поскольку такие малые дозы не оказывают психоактивного действия, такого как те, которые возникают в результате количества, потребляемого для рекреационного использования, которое обычно больше.
В течение одного месяца команда под руководством Андреаса Циммера оценивала способность мышей выполнять когнитивные задачи, такие как тесты в водном лабиринте. Команда наблюдала за способностью мышей вспоминать местоположение безопасных мест или распознавать других субъектов того же вида, с которыми они сталкивались ранее.
Любопытно, что молодые мыши, которым не давали низкие и регулярные дозы ТГk, показали лучшие результаты в поведенческих тестах на память и обучение, чем молодые мыши, которым давали регулярные дозы ТГk. С другой стороны, с более старыми мышами дело обстояло наоборот: те, которые получали низкие и регулярные дозы ТГk, имели лучшие результаты в тестах, чем зрелые и старые мыши, которым ТГk не вводили. Мыши с регулярными малыми дозами также работали в течение более короткого периода времени.
Это исследование подтверждает выводы, которые были сделаны ранее с использованием синтетического каннабиноида, WIN, где пожилые мыши продемонстрировали улучшение памяти после введения канна6иноидов. В исследовании 2018 года старым самкам мышей в возрасте 24 месяцев однократно вводили 0,002 мг/кг ТГk. По сравнению с мышами, получавшими носитель (носитель содержал в основном физиологический раствор, а также немного этанола и кремофора), мыши, получавшие ТГk, показали лучшие результаты в серии из 6 различных поведенческих тестов. Однократная инъекция ТГk также повышала уровень сиртуина-1, фермента, связанного с нейропластичностью и нейропротекцией.
Снижение когнитивных функций в результате старения не считается нейродегенеративным заболеванием, хотя его можно считать патологическим. Практически не существует лечения возрастного снижения когнитивных функций, кроме здорового питания, физических упражнений и мозговой активности. Исследования на грызунах продемонстрировали чрезвычайные перспективы ТГk, особенно в лечении когнитивного дефицита у стареющего населения, хотя для подтверждения этих результатов необходимы исследования на людях.
Случай использования канна6иноидных кислот для нейропротекции
В этой статье в основном исследованы фитоканна6иноиды ТГk и kБД, но есть также случай канна6иноидов в их кислой форме (ТГk-А и kБД-А). Это предшественники ТГk и kБД, и они существуют до того, как происходит процесс декарбоксилирования. Декарбоксилирование удаляет карбоксильную группу, превращая ТГk-А в ТГk (и kБД-А в kБД).
В этом исследовании 2017 года, опубликованном в Британском журнале фармакологии, исследователи исследовали потенциал шести различных фитоканна6иноидов в отношении связывания PPARγ. PPARγ является одним из типов ядерного фактора транскрипции и чаще всего применяется при лечении диабета. Это потому, что он регулирует реакцию на инсулин в жировых клетках. Однако активация PPARγ также влияет на микроглию, и поэтому недавно возник интерес к его применению при хронических нейровоспалительных заболеваниях.
Исследование показало, что канна6иноидные кислоты связываются и активируются с PPARγ намного лучше, чем их декарбоксилированные версии. Было обнаружено, что ТГk-А обладает нейропротекторным действием у мышей, улучшая двигательные нарушения и предотвращая дегенерацию полосатого тела.
Кислая форма ТГk не обладает психоактивным действием и поэтому является особенно подходящим лекарственным канна6иноидом для изучения. Будучи непсихоактивным, он подходит для широкой демографической группы людей, включая детей и пожилых людей, которые наиболее склонны к нейродегенеративным состояниям.
Эффективность синтетических канна6иноидов
Помимо эндоканна6иноидов и фитоканна6иноидов, в настоящее время внимание уделяется потенциалу различных синтетических канна6иноидов. Например, в исследовании, опубликованном в 1999 году журналом Neuroscience , было обнаружено, что синтетический агонист канна6иноидов R(+)-WIN 55212-2 уменьшает потерю нейронов в гиппокампе in vivo после глобальной церебральной ишемии у крыс. Он также уменьшал объем инфаркта после очаговой церебральной ишемии, вызванной окклюзией средней мозговой артерии.
Менее активный энантиомер (молекула «зеркального изображения») S(-)-WIN 55212-3 оказался неэффективным, а защитный эффект R(+)-WIN 55212-2 блокировался действие антагониста рецептора CB1 «N-(пиперидин-1-ил)-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1Н-пиразол-3-карбоксамид-HCl».
Интересно, что R(+)-WIN 55212-2 также защищал культивируемые нейроны коры головного мозга от гипоксии in vitro и депривации глюкозы, но этот эффект был нечувствителен к антагонистам рецепторов CB1 и CB2 . Необходимы дальнейшие исследования, чтобы установить точное взаимодействие здесь, но ясно, что существуют потенциальные применения этого и других синтетических канна6иноидов для лечения церебральной ишемии, включая инсульт.
Канна6иноиды могут обладать нейропротекторными свойствами
На животных моделях имеется множество доказательств, свидетельствующих об эффективности целого ряда фитоканна6иноидов в лечении и смягчении последствий черепно-мозговой травмы, ишемического инсульта и возрастного снижения когнитивных функций. Кроме того, растет наше понимание роли эндогенных канна6иноидов анандамида и 2-AG в модуляции воспаления и мозгового кровотока. Это направление исследований делает эндоканна6иноидную систему мишенью для лечения нейродегенеративных состояний.
Хотя требуется гораздо больше исследований, особенно на людях, количество доказательств в поддержку канна6иноидов для лечения нейродегенеративных расстройств продолжает расти. Механизмы действия, с помощью которых канна6иноиды проявляют нейропротекторные свойства, широко распространены, сложны и заслуживают дальнейшего изучения.